Занимательная химия
Для учащихся 8 класса

9 фактов о Менделееве
1. Семнадцатый ребенок в семье
Дмитрий Иванович Менделеев родился 8 февраля 1834 года в Тобольске — первой столице Сибирского края. Он был последним в семье — семнадцатым ребёнком. Семья, впрочем, была не такой большой: из 17 детей восемь умерли еще в младенчестве.
Отец Дмитрия — Иван Павлович Менделеев — занимал почетную должность директора Тобольской гимназии. Он скончался, когда Дмитрию исполнилось 13 лет, поэтому содержать большую семью пришлось матери — Марии Дмитриевне, которая приложила много усилий для того, чтобы ее дети получили достойное образование. Благодаря ей Дмитрий смог поступить в Главный педагогический институт (ныне Санкт-Петербургский государственный университет).
2. Непокорный учитель
Дмитрий Менделеев имел впечатляющий педагогический опыт. Он работал старшим учителем естественных наук в Симферопольской мужской гимназии (1855 год) и Ришельевском лицее в Одессе (1855−56), а с 1857 года стал преподавать в Императорском Санкт-Петербургском университете, где проработал в общей сложности около 30 лет. Однако из-за конфликта с министром народного просвещения Иваном Деляновым Менделеев покинул университет в 1890 году. Причиной конфликта стал отказ министра принять петицию студентов. Родные и друзья вспоминают Дмитрия Ивановича как человека упорного, который не желал уступать. Так случилось и в случае с петицией. Менделеев пользовался огромным авторитетом в студенческой среде. Когда в марте 1890 года в университете начались студенческие волнения, его пригласили на одно из обсуждений и попросили подать петицию Правительству, в которой студенты изложили свои пожелания, среди которых, в частности, была свобода слова и печати. На отказ Делянова Дмитрий Иванович отреагировал кардинально. Свою последнюю лекцию, которую ученый прочитал 22 марта 1890 года, он завершил словами: «Покорнейше прошу не сопровождать моего ухода аплодисментами по множеству различных причин».
3. «Изобретатель» водки
Существует мнение, что Дмитрий Иванович Менделеев изобрел водку. Однако этот алкогольный напиток, конечно же, существовал задолго до 1865 года, когда он защитил докторскую диссертацию на тему «Рассуждение о соединении спирта с водою». Именно эта работа породила легенду, согласно которой он «принимал участие в разработке производства водки». В своей книге «Национальная легенда: был ли Менделеев создателем русской «монопольной» водки» доктор химических наук и директор музея-архива Д.И. Менделеева при ЛГУ Дмитриев Игорь Сергеевич опровергает этот факт. В частности, он утверждает, что «диссертация была посвящена изучению удельных весов спиртоводных растворов в зависимости от концентрации последних и температуры, а самого Менделеева интересовали в первую очередь совсем другие области концентраций, выше 40% по весу».
4. О сне, которого не было
Существует мнение, что однажды во сне Менделеев увидел периодическую таблицу химических элементов, после чего он ее изобрел. Однако ученый опроверг эту легенду, ответив следующее: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». К слову, открытие периодического закона произошло в феврале 1869 года. 17 февраля Дмитрий Менделеев, собираясь в дорогу, начертил набросок таблицы на обратной стороне неприметного письма, в котором его приглашали приехать и помочь производству. Ученый позже скажет, что тогда «невольно зародилась мысль о том, что между массой и химическими свойствами должна быть связь». Так, он написал на отдельных карточках названия всех известных элементов, их атомный вес и свойства, а потом расположил их по порядку. Поездку пришлось отложить — ученый с головой погрузился в работу, в результате которой был открыт периодический закон химических элементов. Стоит заметить, что в то время около 60 химических элементов было изучено, а свыше тридцати еще ожидали своего времени. В 1870 году Менделеев вычислил атомные массы элементов, которые в его таблице оставались «пустыми» неизученными местами. Так ученым было предсказано существование «экаалюминия» (галлий), «экабора» (скандий), «экасилиция» (германий) и других элементов.
5. Чемоданных дел мастер
Великий ученый занимался не только научной работой. В свободное время он любил изготавливать… чемоданы. Это ремесло Менделеев освоил в Симферополе, когда из-за Крымской войны была закрыта гимназия, в которой он преподавал. Сидеть без дела ученый не любил, поэтому нашел себе увлекательное занятие: стал переплетать книги и склеивать всевозможные подручные предметы, такие как рамки и столики. Особенно ему нравилось возиться с дорожными сумками. Так у Менделеева появилось интересное занятие — изготовление чемоданов, которое он довел до совершенства. Даже когда ученый ослеп в 1895 году, он продолжал клеить чемоданы на ощупь. Однажды во время очередной покупки кожи один покупатель поинтересовался у купца, кто этот человек, на что получил ответ: «Это известный, знаменитый чемоданных дел мастер Менделеев!»
6. Не нобелевский лауреат
Дмитрий Менделеев был выдвинут на Нобелевскую премию несколько раз, но так и не получил ее. В первый раз это случилось в 1905 году. Тогда лауреатом стал немецкий химик-органик Адольф Байер. Через год ученый был объявлен победителем премии, но Шведская королевская академия наук отменила это решение в пользу французского учёного Анри Муассана за открытие фтора. В 1907 году прозвучало предложение разделить премию с итальянским химиком Станислао Канниццаро, однако в этот раз вмешалась судьба. 2 февраля 1907 года в возрасте 72 лет Менделеев ушел из жизни. Возможно, причиной, почему ученый так и не стал обладателем долгожданной премии, являлся конфликт между Дмитрием Ивановичем и братьями Нобель. К концу 19-го века предприимчивые шведы разбогатели на бакинской нефти и стали контролировать более 13% российских месторождений. В 1886 году, когда цена на нефть резко упала, братья Нобель предложили правительству поднять налог, аргументируя это быстрым истощением месторождения. Таким образом, повышение цен в размере 15 копеек с пуда нефти обеспечивало им избавление от конкурентов. При Министерстве государственных имуществ была образована специальная комиссия, в состав которой вошел Менделеев. Ученый был противником введения налога и опроверг слух об истощении нефти, чем и разгневал Нобелей.
7. Полеты на аэростатах
Дмитрий Менделеев работал также над конструкцией летательных аппаратов, с помощью которых он планировал исследовать температуру, давление и влажность в верхних слоях атмосферы. В 1875 году он предложил проект стратостата объёмом 3600 м³. Им же был разработан проект управляемого аэростата с двигателями. В 1878 году ученый совершил полет на привязном аэростате Анри Жиффара на Всемирной выставке в Париже. Через 9 лет он опять поднялся в воздух. В этот раз местом для эксперимента был выбран пустырь на северо-западе города Клин. 7 августа 1887 года на предоставленном Военным министерством воздушном шаре «Русский» (объём 700 м³) Менделеев в одиночку поднялся на высоту более 3000 метров. Полет продолжался три часа. За это время ученый измерил давление и температуру, а также стал свидетелем полного солнечного затмения. Этот полет был отмечен медалью французской Академии аэростатической метеорологии.
8. Пионер ледоколостроения
Интересно, что из всего количества трудов ученый посвятил химии около 10%. Кроме всего прочего, Менделеев уделял внимание кораблестроению и освоению арктического мореплавания, о чем написал около 40 работ. Он принимал непосредственное участие в проекте строительства первого в мире арктического ледокола «Ермак», который был впервые спущен на воду 29 октября 1898 года. За большой вклад в освоение Арктики именем ученого был назван подводный хребет в Северном Ледовитом океане, открытый в 1949 году.
9. Тесть Блока
Менделеев говорил, что «много испытал в жизни, но не знает ничего лучше детей». Знающие его люди рассказывали, что он часто угощал сладостями детей сторожей в Палате мер и весов, где он работал, а также устраивал для них новогоднюю елку за свой счет. Дмитрий Иванович был отцом шестерых детей: двое родились от первого брака с Феозвой Лещёвой, четверо — от второго брака с Анной Поповой.
Старший сын Владимир был морским офицером. Ему посчастливилось плавать на фрегате «Память Азова», на котором Николай II должен был отправиться в путешествие на Дальний Восток. После свадьбы с дочерью художника-передвижника Варварой Кирилловной Лемох он скоропостижно умер. О старшей дочери Ольге известно, что она разводила породистых охотничьих собак, а после революции была вынуждена переехать в Москву, где по протекции Дзержинского работала консультантом питомника служебных собак. Ее младшая сестра Мария Дмитриевна Кузьмина также занималась собаками, однако после войны стала заведовать музеем своего отца при Ленинградском государственном университете. Интересно сложилась судьба дочери Любы. Она работала артисткой в труппе Мейерхольда и вышла замуж за Александра Блока. По стопам отца пошел Иван, который работал в институте метрологии. А вот судьба младшего сына Василия сложилась весьма загадочно. Он учился на кораблестроительном отделении Кронштадтского морского инженерного училища, но так и не закончил учебу. Говорят, что Василий пошел против родительской воли, женившись на простонародной Фене, после чего ушел из дома. О нем долго ничего не было слышно, но позже выяснилось, что он умер в 1922 году в Краснодаре, заразившись от жены брюшным тифо


Для учащихся 9 класса
Алгоритм составления названий одноатомных спиртов
- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
- Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Тест
1. Предельным одноатомным спиртом является:
А) СH2O
Б) C2H4O2
В) C3H6O
Г) C5H12O
2. Вторичный одноатомный спирт – это:
А) СH3 CH CH CH3 В) СН3 СН2 СН2 ОН
OH CH3 СН3
Б) СН3 ОН Г) СН3 С СН3
ОН
3. Изомером пентанола-1 является:
А) СН3 (СН2)4 ОН В) СН3 СН2 ОН
СН3 ОН
Б) СН3 С СН2 СН3 Г) СН3 (СН2)2 С СН3
ОН ОН
СН3 СН3
4. СН3 СН СН СН2 ОН - это:
А) 2,3-диметилбутанол-1
Б) 2-метилбутанол-2
В) 2-метилпропанол-1
Г) 2,3,4-триметилпентанол-2
5. СН3 СН2 СН СН3 - это:
ОН
А) одноатомный вторичный предельный спирт
Б) двуатомный первичный предельный спирт
В) одноатомный третичный непредельный спирт
Г) одноатомный вторичный непредельный спирт
Амины
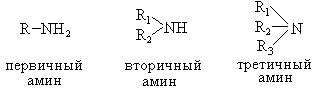
Для учеников 10 класса

Задача 1. Напишите уравнения реакций, позволяющих осуществить следующие превращения:
NаСl → Nа → NаН → NаОН → NаНSО3.
Решение. Натрий образуется при электролизе расплава хлорида натрия:
2NаСl = 2Nа + Сl2↑.
Натрий реагирует с водородом:
2Nа + Н2 = 2NаН.
Гидрид натрия полностью гидролизуется под действием воды:
NаН + Н2О = NаОН + Н2↑.
При пропускании избытка сернистого газа через раствор гидроксида натрия образуется гидросульфит натрия:
NаОН + SО2 = NаНSО3.
Задача 2. При действии избытка углекислого газа на 32,9 г неизвестного соединения металла с кислородом образовалось твердое вещество “А”, и выделился газ “В”. Вещество “А” растворили в воде, и добавили избыток раствора нитрата бария, при этом выпало 27,58 г осадка. Газ “В” пропустили через трубку с раскаленной медью, и масса трубки увеличилась на 6,72 г. Установите формулу исходного соединения.
Решение. Из условия задачи ясно, что после пропускания СО2 над кислородным соединением металла образовался карбонат металла, причем щелочного (поскольку карбонаты только щелочных металлов достаточно хорошо растворимы в воде), и выделился кислород. Пусть формула исходного соединения – МеxОy. Уравнения реакций:
2МехОу + хСО2 = хМе2СО3 + (у-0,5х)О2↑,
Ме2СО3 + ВаСl2 = 2МеСl + ВаСО3↓,
2Сu + О2 = 2СuО.
Увеличение массы трубки с нагретой медью равно массе прореагировавшего по последней реакции кислорода, поэтому: v(О2) = 6,72/32 = 0,21 моль.
По второй реакции, v(ВаСО3) = 27,58 / 197 = 0,14 моль = v(Ме2СО3), следовательно, v(Ме) = 2 • v(Ме2СО3) = 0,28 моль. Отношение коэффициентов в уравнении реакции равно отношению количеств веществ (в молях), поэтому из первого уравнения следует, что х/(у-0,5х) = 0,14/0,21, откуда получаем, что х:у = 1:2. Поэтому можно заключить, что простейшая формула кислородного соединения - МеО2.
Поскольку v(МеО2) = v(Ме) = 0,28 моль, то молярная масса кислородного соединения равна: М(МеО2) = 39,2 / 0,28 = 117,5 г/моль, а атомная масса металла: М(Ме) = 117,5-32 = 85,5 г/моль. Этот металл - рубидий, Rb. Искомая формула — RbО2.
Ответ. RbО2.
Задача 3. При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен.
Решение. Поскольку металл двухвалентен, его реакция с водой
описывается уравнением:
Ме + 2Н2О = Ме(ОН)2 + Н2↑.
Согласно уравнению, v(Ме) = v(Н2) = 3,36/22,4 = 0,15 моль. Отсюда атомная масса металла равна A(Ме) = m/v = 6,0/0,15 = 40 г/моль. Этот металл - кальций.
Ответ. Кальций.
Жёсткость воды

Жесткость воды – это совокупность свойств, обусловленных содержанием в воде ионов 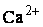 и
и 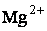 . Суммарная концентрация ионов
. Суммарная концентрация ионов 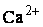 (кальциевая жесткость воды) и
(кальциевая жесткость воды) и 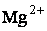 (магниевая жесткость воды) называется общей жесткостью. Общая жесткость включает карбонатную жесткость, обусловленную содержанием в воде гидрокарбонатов кальция и магния, и некарбонатную, обусловленную содержанием в воде сульфатов и хлоридов кальция и магния. Карбонатную жесткость можно снизить кипячением, поэтому такую жесткость называют временной. Некарбонатная жесткость не уменьшается при кипячении, поэтому ее называют постоянной.
(магниевая жесткость воды) называется общей жесткостью. Общая жесткость включает карбонатную жесткость, обусловленную содержанием в воде гидрокарбонатов кальция и магния, и некарбонатную, обусловленную содержанием в воде сульфатов и хлоридов кальция и магния. Карбонатную жесткость можно снизить кипячением, поэтому такую жесткость называют временной. Некарбонатная жесткость не уменьшается при кипячении, поэтому ее называют постоянной.
Величину жесткости природных вод выражают в миллиэквивалентах на 1 л воды (мэкв/л). Один миллиэквивалент жесткости отвечает содержанию 20,40 мг/л 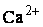 или 12,16 мг/л
или 12,16 мг/л 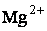 .
.
ПРИМЕР 1. Вычислить жесткость воды, зная, что 500 л ее содержат 202,5 г гидрокарбоната кальция.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г 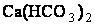 , что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л (81 г/моль –экивалентная масса
, что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л (81 г/моль –экивалентная масса 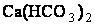 ). Следовательно, жесткость воды 5 мэкв/л.
). Следовательно, жесткость воды 5 мэкв/л.
ПРИМЕР 2. Сколько граммов сульфата кальция содержится в 1 м3 воды, если жесткость воды, обусловленная присутствием этой соли, равна 4 мэкв/л?
Решение. Мольная масса 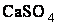 равна 136,14 г/моль; эквивалентная масса равна 136,14 : 2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 мэкв/л содержится 4•1000 = 4000 мэкв, или 4000•68,07 = 272280 мг = 272,280 г
равна 136,14 г/моль; эквивалентная масса равна 136,14 : 2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 мэкв/л содержится 4•1000 = 4000 мэкв, или 4000•68,07 = 272280 мг = 272,280 г 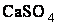 .
.
Жесткость природных вод колеблется в очень широких пределах – от 0,1 - 0,2 мэкв/л в водах рек и озер, расположенных в зонах тайги и тундры, до 80 - 100 мэкв/л в некоторых подземных водах и водах морей и океанов. Повышенная жесткость в водах природных источников обусловлена контактом воды с горными породами, содержащими карбонаты и сульфаты.
Применение жесткой воды недопустимо в некоторых отраслях промышленности, например в теплоэнергетике, так как в котлах и отопительных приборах образуется накипь, что ухудшает теплообмен. Поэтому жесткость является одним из показателей качества воды, который необходимо контролировать.
При необходимости использования водоисточника с высокой жесткостью воды применяют специальные методы умягчения воды. Умягчение может быть осуществлено переводом солей жесткости в труднорастворимые или комплексные соединения, перегонкой воды, методом ионного обмена.
При умягчении воды методом осаждения соли жесткости переводят в следующие труднорастворимые соединения: карбонат кальция, гидроксидмагния, трехзамещенные фосфаты. В зависимости от применяемого осадителя способы обработки называют известкованием, содоизвесткованием,фосфатированием.
Процессы, протекающие при известковании (обработка известью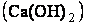 , описываются уравнениями:
, описываются уравнениями:
Для учеников 11 класса
спирты

Виды сахаров
• Глюкоза — самый простой сахар. Он быстро попадает в кровеносную систему. Ее также называют декстрозой, если добавляют в какие-то компоненты. Организм человека, так или иначе, расщепляет все сахара и углеводы, превращая их в глюкозу, потому что глюкоза — это та форма, в которой клетки могут принимать сахара и использовать его для получения энергии.
• Сукроза (столовый сахар) состоит из молекулы глюкозы и молекулы фруктозы. Существует много форм белого сахара. Он может иметь вид сахарной пудры или быть гранулированным. Обычно столовый сахар делают из экстрактов сахарной свеклы или сахарного тростника.
• Фруктоза — один из главных видов сахаров, содержится в меде и фруктах. Усваивается более медленно и не сразу попадает в кровеносную систему организма. Используется весьма широко. Внимание! Обычно фруктоза ассоциируется с фруктами, которые также содержат другие питательные вещества. Когда фруктоза используется отдельно, она, по сути, представляет собой то же самое, что простые сахара, т.е. просто уйму калорий.
• Лактоза — сахар, который содержится в молочных продуктах. Состоит из молекулы глюкозы и молекулы галактозы (галактоза замедляет процесс расщепления сахара и попадания его в кровеносную систему). В отличие от глюкозы, которая очень быстро всасывается в стенки кишечника и попадает в кровь, лактозе для усвоения нужен особый фермент — лактаза, способствующий расщеплению сахаров, после чего они могут всасываться в стенки кишечника. Некоторые люди плохо переносят лактозу, потому что их организм не производит лактазу, расщепляющую молочный сахар.
• Мальтоза состоит из двух молекул глюкозы. Содержится в ячмене и других злаковых. Если в состав пива входит мальтоза, оно способствует быстрому повышению уровня сахара в крови.
• Черная патока — густой сироп, который является побочным продуктом переработки сахара. Однако в отличие от столового сахара, он содержит ценные вещества. Чем темнее патока, тем больше ее питательная ценность. Например, черная патока является источником таких микроэлементов, как кальций, натрий и железо, и в ней также есть витамины группы В.
• Коричневый сахар — это обычный столовый сахар, который становится бурым из-за того, что в него добавляют патоку. Он полезнее, чем простой белый сахар, однако содержание в нем питательных веществ и витаминов невелико.
• Сахар-сырец — это название призвано вводить потребителей в заблуждение, заставляя их думать, что такой сахар содержит полезные вещества и микроэлементы. Термин сырец предполагает, что этот сахар отличается от обычного столового и более полезен для организма. Однако на самом деле такой сахар просто имеет кристаллы большего размера и при его производстве добавляется патока. Крупные кристаллы — это вовсе не большие молекулы, способствующие медленному усвоению.
• Кукурузный сироп представляет собой сахар, полученный из кукурузы. Экстракт такого сахара трудно назвать полезным. В этом смысле он ничем не лучше обычного столового сахара. Все сиропы являются концентратами: столовая ложка сиропа содержит вдвое больше калорий, чем столовая ложка обычного сахара. И хотя в сиропах сохраняется ничтожное количество витаминов и микроэлементов, например кальция, фосфора, железа, калия, натрия, их полезные свойства не превосходят характеристики обычного сахара. Поскольку кукурузный сироп дешев в производстве, он является весьма распространенным подсластителем для напитков и соков. А так как он содержит много калорий, его вряд ли можно встретить в списке полезных для здоровья продуктов питания. У некоторых людей отмечается аллергия на кукурузу, поэтому им следует внимательно читать список ингредиентов.
• Кукурузный сироп с высоким содержанием фруктозы — это подсластитель, содержащий от 40% до 90% процентов фруктозы. И конечно, это экстракт кукурузы. Он дешев, и его широко используют производители продуктов питания, в основном для подслащивания готовых каш и газированных напитков.
- Продукты гидролиза сахарозы:
А) Галактоза, фруктоза Б) рибоза, галактоза С) глюкоза, фруктоза Д) рибоза , фруктоза
- Виноградным сахаром называют:
А) Крахмал Б) Целлюлозу С) Сахарозу Д)рибозу Е) Глюкозу
- Вещество которое относится к дисахаридам:
А) Крахмал Б) Фруктоза С) Сахароза Д)Глюкоза
- Целлюлозу не получают из:
А) Льна Б) Картофеля С) Хлопка Д)Конопли
- Целлюлоза-.... полимер
А) Химический и синтетический Б) натуральный и синтетический С) Натуральный и растительного происхождения Д)натурального и животного происхождения
- Пчелиный мед состоит в основном из смеси:
А) Рибозы и дезоксирибонуклеиновый Б) крахмала и глюкозы С) глюкозы и сахарозы
Д)глюкозы и фруктозы
- Макромолекулы целлюлозы состоят из остатков:
А) ß- глюкозы Б) Фруктозы С) Рибозы Д) мальтозы
- Вещество, которое не применяют для получения глюкозы:
А) мальтоза Б) сахароза С) крахмал Д) глицерин
- На какие группы подразделяются углеводы?
А) моносахариды и полисахариды Б) дисахариды и полисахариды С) мукополисахариды Д) моносахариды, дисахариды, полисахариды
- Название углеводов имеют окончание:
А) - аза Б)- ол С) – окси Д) - оза
- Какой фермент выступает в роли катализатора в процессе фотосинтеза?
А) Гемоглобин Б) амилаза С) хлорофилл Д) уреаза
- Какой из этих моносахаридов применяются при исскуственном кормлении?
А) Фруктоза Б) Маноза С) галактоза Д) Глюкоза
- Какой моносахарид самый сладкий?
А) Фруктоза Б) Маноза С) галактоза Д) Глюкоза
- сколько атомов углерода содержится в молекулах моносахаридов:
А) 3-7 Б) 2-6 С) 5-10 Д)1-5
- Что образуется в результате брожения глюкозы?
А) 1-пропанол Б) этанол С) 2-пропанол Д) ацетон
- Формула дисахаридов:
А) С6Н10О5 Б) С12Н22О11 С) С5Н10О5 Д) С6Н6
- Какое из этих веществ является реагентом для крахмала?
А) Pb(CH3COO)2 Б) Br2 С)J2 Д)Cu(OH)2
- Какое из свойств доказывает, что глюкоза является пентаспиртом?
А) легкость окисления Б) легкость восстановления С) легко декорбоксилируется Д) протекания реакции дегидратации
- Общая формула полисахаридов:
А) (С6Н10О5)n Б) С12Н22О11 С) С5Н10О5 Д) С6Н6
- Сколько процентов лактозы содержится в молоке матери?
А)2% Б) 100% С)7% Д) 50%
21.Теорию белковой молекулы в 1888г предложил:
А) Ф Крик Б) А Данильевский С) Д Уотсон Д)Л полинг
22.Денатурация белка – это:
А) окисление на воздухе Б) расстворение белка в воде С) изменение структур белка под влиянием внешних воздействий Д)образование коллоидного раствора.
23.Вторичная структура имеет прочную форму благодаря:
А) пептидным связям Б) солевым мостиком С) водородным связям Д) сульфидным мостиком
24.В основе молекулы белка находятся:
А) Аминокислоты Б) Амины С) Спирты Д) Арены
Биология ДПА
Амины
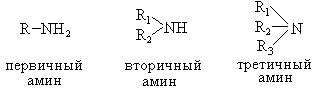
Для 7 класів
Чистые вещества и смеси
Строение атома
Для 8 класів
Для 9 класів
Для 10 класу














Комментариев нет:
Отправить комментарий